Илья Гриднев
|26
Ученые из Японии успешно применили невирусный метод для внедрения генов в организм приматов. Технология позволила получить трансгенных макак-крабоедов со стабильной экспрессией чужеродных генов во всех тканях. Это снимает имевшиеся ограничения в создании трансгенных обезьян.
Биотехнологические исследования на мышах — наиболее распространенном модельном организме — далеко не во всем можно применять на людях. Такие модели часто не воспроизводят сложные человеческие заболевания из-за заметных различий в физиологии. Приматы, такие как макаки-крабоеды, генетически близки к людям, но их генетическая модификация до сих пор требовала вирусных систем, которые имеют ограничения.
Использование некоторых вирусов требует специальных лабораторий повышенной безопасности. Кроме того, вирусы могут переносить только небольшие фрагменты ДНК (до 8-10 тысяч пар оснований) и вызывают случайные мутации. Еще одна проблема — невозможность проверить успешность модификации до переноса эмбрионов в матку. Это приводит к рождению животных без нужных генов, что противоречит этическим нормам.
Группа японских ученых разработала альтернативу вирусным методам. Статья об этом вышла в журнале Nature Communications. Биологи использовали систему piggyBac, которая работает иначе, чем вирусная. Она основана на транспозонах — «прыгающих генах», способных перемещаться внутри генома.
PiggyBac открыли в 1980-х годах у насекомых, но позже адаптировали для млекопитающих. Ключевой компонент системы — фермент транспозаза, который вырезает участок ДНК, окруженный специфическими последовательностями, транспозон, и встраивает его в новое место. В отличие от вирусов, piggyBac не оставляет следов в геноме после удаления транспозона и может переносить гены длиной до 200 тысяч пар оснований.
Исследователи начали с того, что оптимизировали метод на мышах — вводили компоненты piggyBac вместе со сперматозоидами в зрелые яйцеклетки. При концентрации вектора 10 нанограммов на микролитр 62% эмбрионов демонстрировали стабильную экспрессию флуоресцентных белков. Все родившиеся мыши (семь из 21 эмбриона) имели встроенные гены, которые передались 72% потомства.
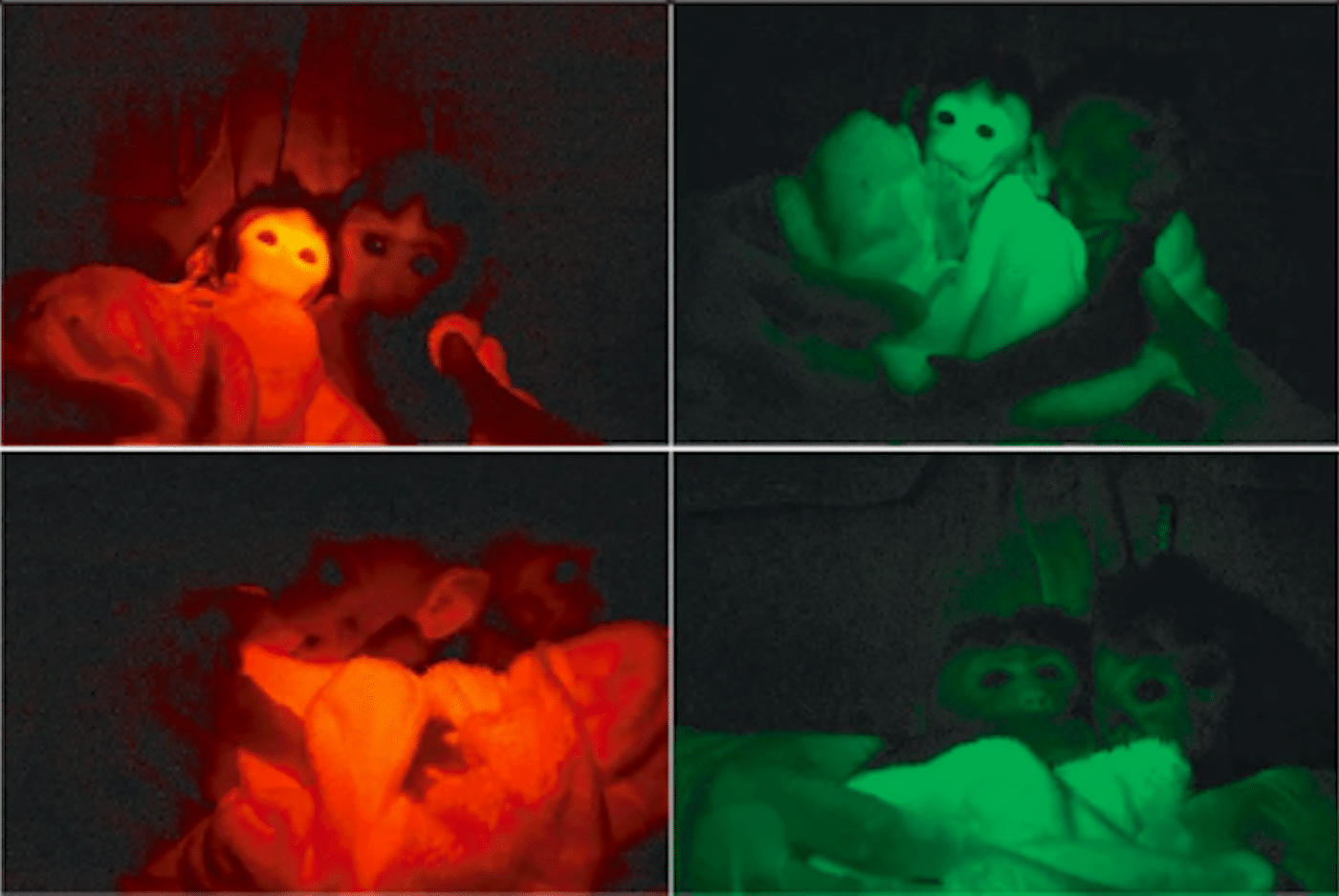
Затем метод применили к макакам-крабоедам. Из 34 эмбрионов 32 показали активность флуоресцентных маркеров. После переноса 20 эмбрионов четырем самкам родились три детеныша. У двух из них красный флуоресцентный белок локализовался в мембранах клеток, а зеленый — в ядрах. Экспрессия генов подтвердилась во всех тканях, включая мозг, сердце и половые клетки. При этом она варьировалась: в сердце и мышцах достигала 95-100%, а в печени и мозге снижалась до 30%.
Анализ ДНК показал, что гены встроились в разные участки генома, но не в критические зоны, такие как стартовые сайты транскрипции. У выживших обезьян обнаружили до четырех сайтов интеграции, тогда как у погибших их было восемь-девять. Это указывает на возможную связь между числом вставок и жизнеспособностью.
Новый метод устранил ключевые ограничения вирусных подходов: риск заражения, размер генов и невозможность ранней проверки эмбрионов. Однако остаются проблемы мозаицизма — неравномерной экспрессии генов в клетках.
В будущем биотехнологи планируют усовершенствовать систему piggyBac для контроля времени встройки генов и повышения точности. Это откроет путь к созданию приматов с моделями нейродегенеративных, иммунных и других заболеваний, которые невозможно изучить на грызунах.
Популярные категории
Популярные статьи

Космонавтика
Японский лунный аппарат SLIM неожиданно вышел на связь из перевернутого положения 29.01.2024


Медицина
Алкоголь на ночь изменил структуру сна 29.01.2024
Биология
Ученые впервые увидели попытку шмелей вылечить свои раны 29.01.2024